Homepage
โครงสร้างอะตอม
นักปราชญ์ชาวกรีกชื่อดิโมคริตุส (Demokritos) ได้ให้แนวคิดไว้ว่า หน่วยย่อยที่เล็กที่สุดของสารคือ อะตอม ซึ่งเป็นอนุภาคที่ไม่สามารถแบ่งให้เล็กลงไปได้อีก
นักวิทยาศาสตร์ได้ศึกษาเรื่องราวเกี่ยวกับอะตอมและแปลผลจากข้อมูลที่ได้จากการทดลองนำมาสร้างเป็นมโนภาพหรือแบบจำลอง ซึ่งมีการพัฒนาตามลำดับดังนี้
1.1แบบจำลองอะตอมของดาลตัน
จอห์นดาลตัน นักวิทยาศาสตร์ชาวอังกฤษ ได้เสนอทฤษฎีอะตอมเพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงมวลของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบหนึ่ง ๆ ซึ่งมีสาระสำคัญดังนี้
1. ธาตุประกอบด้วยอนุภาคเล็ก ๆ หลายอนุภาค อนุภาคเหล่านี้เรียกว่า อะตอม ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน เช่น มีมวลเท่ากัน แต่จะมีสมบัติแตกต่างจากอะตอมของธาตุอื่น
3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อย ๆ
รูปที่ 1 แบบจำลองอะตอมของดาลตัน
นักวิทยาศาสตร์รุ่นต่อมาได้ศึกษาเกี่ยวกับอะตอมเพิ่มขึ้นพบว่าข้อมูลบางประการไม่สอดคล้องกับดาลตัน เช่น อะตอมของธาตุชนิดเดียวกัน อาจมีมวล แตกต่างกันได้ และอะตอมสามารถแบ่งแยกได้ นักวิทยาศาสตร์ได้ศึกษาเพิ่มเติม และจึงได้พัฒนาแบบจำลองอะตอมขึ้นมาใหม่
1.2.1 หลอดรังสีแคโทด
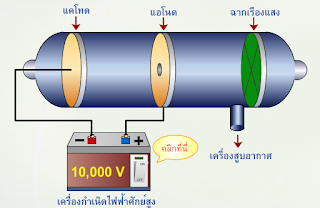
นักวิทยาศาสตร์ศึกษาการนำไฟฟ้าของแก๊สโดยผ่านไฟฟ้ากระแสตรงที่มีความต่างศักย์ระหว่างขั้วไฟฟ้าสูงเข้าไปในหลอดแก้วที่บรรจุแก๊สความดันต่ำ ปรากฏว่าจะเกิดรังสีพุ่งออกจากแคโทดไปยังแอโนด เรียกรังสีชนิดนี้ว่า รังสีแคโทด และเรียกหลอดแก้วนี้ว่า หลอดรังสีแคโทด ดังแสดงในรูปที่ 2
รูปที่ 2 หลอดรังสีแคโทด
1.2.2 หลอดรังสีแคโทดที่ดัดแปลงแล้ว
ทอมสันได้ทดลองเกี่ยวกับหลอดรังสีแคโทดเพิ่มเติมจำนวนมาก โดยดัดแปลงลักษณะของหลอดรังสีแคโทดจากเดิมเล็กน้อย เช่น มีการเติมฉากเรืองแสงไว้ในหลอดรังสีด้วยดังในรูปที่ 3และทอมสันได้นำผลการทดลองในลักษณะต่าง ๆ มาสรุปเกี่ยวกับแบบจำลองอะตอม โดยทำเป็นขั้น ๆ ดังนี้
รูปที่ 3 หลอดรังสีแคโทดที่ดัดแปลงแล้ว
ผลการทดลองของทอมสันพบว่า ในตอนแรกความดันในหลอดแก้วมีมาก จะยังไม่เห็น
1) บรรจุแก๊สชนิดหนึ่งในหลอดรังสีแคโทด ที่ขั้วแอโนด และขั้วแคโทด ต่ออยู่กับเครื่องกำเนิดไฟฟ้ากระแสตรง ศักย์สูงที่ขั้วแอโนดเจาะรูเล็ก ๆ ตรงกลาง และ ปลายด้านหนึ่งของหลอดรังสีมีฉากเรืองแสง (ทำด้วย ZnS) วางไว้ นำหลอดรังสีนี้ต่อเข้ากับเครื่องสูบสูญอากาศการเปลี่ยนแปลงใด ๆ ที่ฉากเรืองแสง แม้ว่าจะใช้ศักย์ไฟฟ้าสูง ๆ ก็ตาม ต่อเมื่อลดความดันในหลอดแก้วให้ต่ำลงมาก ๆ จนเกือบเป็นสุญญากาศ จะมีจุดสว่างเกิดขึ้นที่ฉากเรืองแสง บริเวณที่ตรงกับรูที่เจาะไว้ที่แอโนด
2) เพื่อทดสอบสมมติฐานที่ว่าอะตอมประกอบด้วยอนุภาคที่มีประจุ และต้องการจะทราบว่าประจุไฟฟ้าที่มากระทบฉากเรืองแสง เป็นประจุบวกหรือประจุลบ ทอมสันจึงทดลองต่อไปโดยใช้สนามไฟฟ้าเข้าช่วย โดยยึดหลักว่า อนุภาคที่มีประจุจะต้องเกิดการเบี่ยงเบนในสนามไฟฟ้า ถ้าอนุภาคนั้นมีประจุบวกจะเบี่ยงเบนเข้าหาขั้วลบของสนามไฟฟ้า และถ้ามีประจุลบจะเบี่ยงเบนเข้าหาขั้วบวก ทั้งนี้ศึกษาการเบี่ยงเบนได้จากฉากเรืองแสง ดังรูปภาพที่ 4
รูปที่ 4 หลอดรังสีแคโทดที่มีการต่อสนามไฟฟ้าภายนอกเข้าไป
จากการทดลองพบว่าจุดสว่างบนฉากเรืองแสง เบนไปจากตำแหน่งเดิม คือเบี่ยงเบนขึ้นสู่ด้านบน ซึ่งถ้าลากเส้นจากขั้วไฟฟ้าจะเห็นว่ารังสีนั้นเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า แสดงว่ารังสีนั้นจะต้องประกอบด้วยอนุภาคที่มีประจุจึงเกิดการเบี่ยงเบนขึ้น ดังรูปที่ 5
การที่แนวของรังสีเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า ก็แสดงว่ารังสีนั้นจะต้องประกอบด้วยอนุภาคที่มีประจุลบ
รูปที่ 5 แนวของรังสีแคโทดเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า
ซึ่งสังเกตได้จากจุดสว่างที่อยู่ตำแหน่งบนของฉากเรืองแสง
เมื่อทดลองถึงขั้นนี้ ทำให้ทอมสันตั้งสมมติฐานว่า อะตอมประกอบด้วยอนุภาคเล็ก ๆ ที่ส่วนหนึ่งมีประจุลบ แต่ยังไม่ทราบว่าอนุภาคที่มีประจุลบเหล่านี้เกิดจากแก๊สในหลอดรังสีหรือเกิดจากขั้วไฟฟ้า และไม่ทราบว่ารังสีแคโทดนี้จะเหมือนกันหรือไม่ จะประกอบด้วยอนุภาคชนิดเดียวกันหรือไม่ และถ้าใช้แก๊สต่างชนิดกันจะมีลักษณะเหมือนหรือต่างกันอย่างไร
3) ทอมสันศึกษาสมบัติของรังสีแคโทดต่อไป โดยหาอัตราส่วนระหว่างประจุต่อมวลของรังสีนั้น ทั้งนี้อาศัยหลักที่ว่านอกจากรังสีแคโทดจะเบี่ยงเบนได้ในสนามไฟฟ้าแล้ว ยังสามารถเบี่ยงเบนได้ในสนามแม่เหล็กด้วย
ในตอนแรกทอมสันได้ทดลองเปลี่ยนแก๊สชนิดต่าง ๆ ในหลอดรังสีแคโทดแล้วทดลองในทำนองเดียวกัน ปรากฏว่าได้ผลการทดลองเหมือนเดิม และเมื่อลองเปลี่ยนชนิดของขั้วไฟฟ้าที่ใช้ทำแคโทดก็ยังคงพบว่า ยังได้ผลการทดลองเหมือนเดิมอีกเช่นกัน คือจะมีรังสีที่ประกอบด้วยอนุภาคที่มีประจุลบพุ่งมาที่ฉากเรืองแสง และรังสีเกิดการเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า จึงทำให้ไม่สามารถพิสูจน์ได้ว่าอนุภาคที่มีประจุลบนั้นเป็นอนุภาคชนิดเดียวกันหรือไม่
ทอมสันจึงได้ทดลองต่อไปอีก โดยนำหลอดรังสีวางไว้ในสนามแม่เหล็ก ทั้งนี้ในทิศทางของสนามแม่เหล็กตั้งฉากกับสนามไฟฟ้าดังในรูปที่ 6
รูปที่ 6 การเพิ่มสนามแม่เหล็กเข้าไปในการทดลองของทอมสัน
ในช่วงแรกที่ใส่สนามแม่เหล็กเข้าไป จุดสว่างบนฉากเรืองแสง จะเบี่ยงเบนขึ้นด้านบน เมื่อใส่สนามแม่เหล็กเข้าไป และเพิ่มอำนาจสนามแม่เหล็กทีละน้อยจะพบว่าจุดสว่างบนฉากเรืองแสงค่อย ๆ มีการเบี่ยงเบนน้อยลง คือจุดเรืองแสงค่อย ๆ กลับมาสู่ตำแหน่งเดิมเหมือนตอน ที่ไม่มีสนามไฟฟ้า
ผลจากการทดลองดังกล่าวแสดงว่าในขณะนี้ความแรงของสนามไฟฟ้ามีค่าเท่ากับความแรงของสนามแม่เหล็ก จุดสว่างบนฉากเรืองแสงจึงไม่มีการเบี่ยงเบน
เมื่อนำความแรงของสนามไฟฟ้า และความแรงเนื่องจากสนามแม่เหล็กที่กระทำต่ออนุภาคลบมาคำนวณหาอัตราส่วนของประจุต่อมวล (e/m) ของอนุภาคลบนั้น ปรากฏว่าได้ค่าคงที่เท่ากันทุกครั้ง ไม่ว่าทอมสันจะใช้แก๊สชนิดใด หรือไม่ว่าจะใช้โลหะใดเป็นแคโทด คือได้
จากผลการทดลอง และผลการคำนวณ ทำให้ทอมสันสรุปว่า “ อนุภาคลบในรังสีแคโทดจะต้องมีลักษณะเหมือนกัน และอะตอมทุกชนิดย่อมจะมีอนุภาคที่มีประจุลบเป็นองค์ประกอบเหมือนกัน และเรียกอนุภาคลบนี้ว่า อิเล็กตรอน ”
1.2.3 การค้นพบโปรตอน
เนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดจะต้องประกอบด้วยอิเล็กตรอนซึ่งมีประจุลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอมจะต้องมีอนุภาคที่มีประจุบวกอยู่ด้วย
ออยเกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทดเล็กน้อย ดังรูปที่ 7
ข ก
รูปที่ 7 การทดลองของโกลด์สไตน์
ที่มา : http://tinyurl.com/3xzuxb7
โกลด์สไตน์ได้เลื่อนขั้วแคโทดและแอโนดมาไว้เกือบตรงกลาง แล้วเพิ่มฉากเรืองแสง ข ที่ปลายด้านหนึ่งของหลอดแก้ว (ซ้ายมือ) โดยคิดว่าการที่อนุภาคที่มีประจุลบสามารถเคลื่อนที่ผ่านขั้วแอโนดไปที่ฉากเรืองแสง ก. ได้อนุภาคที่มีประจุบวกก็ควรจะเคลื่อนที่ผ่านแคโทดไปที่ฉากเรืองแสง ข ได้ เช่นเดียวกัน ดังนั้นจึงเจาะรูตรงกลางของขั้วแอโนดและแคโทดไว้ จากการทดลองเมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งบนฉากเรืองแสง ก และ ข ซึ่ง โกลด์สไตน์ อธิบายว่า จุดสว่างที่เกิดขึ้นบนฉากเรืองแสง ข จะต้องเกิดจากรังสีที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทดไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซหรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
จากการทดลองหลาย ๆ ครั้งโดยการเปลี่ยนชนิดของแก๊สในหลอดแก้ว ปรากฏว่าอนุภาคที่มีประจุบวกเหล่านี้มีอัตราส่วนของประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของแก๊สที่ใช้ และเมื่อทดลองโดยเปลี่ยนโลหะที่ใช้ทำขั้วไฟฟ้าหลาย ๆ ชนิด แต่ใช้ในหลอดแก้วชนิดเดียวกัน ปรากฏว่าผลการทดลองได้อัตราส่วนของประจุต่อมวลเท่ากัน แสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากแก๊สไม่ได้เกิดจากขั้วไฟฟ้า
ต่อมาโกลด์สไตน์ได้พบว่าถ้าทำการทดลองโดยใช้แก๊สไฮโดรเจน จะได้อนุภาคที่มีจำนวนประจุเท่ากับประจุของอิเล็กตรอน และเรียกอนุภาคบวกที่เกิดจากแก๊สไฮโดรเจนว่า โปรตอน อะตอมของแก๊สไฮโดรเจนจะมี 1 โปรตอน และอะตอมของธาตุอื่น ๆ อนุภาคบวกจะมีมากกว่า 1 โปรตอน แต่จำนวนโปรตอนและอิเล็กตรอนเท่ากัน
จากผลการทดลองที่ผ่านมา ทั้งของทอมสันและของโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยว กับอะตอมมากขั้น จึงได้เสนอแบบจำลองอะตอมดังนี้
“ อะตอมมีลักษณะเป็นทรงกลม ประกอบด้วยอนุภาคโปรตอนที่มีประจุบวก และอนุภาค
อิเล็กตรอนซึ่งมีประจุลบกระจายอยู่ทั่วไปอย่างสม่ำเสมอในอะตอม อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับประจุลบ”
รูปที่ 8 แบบจำลองอะตอมของทอมสัน
ที่มา : http://tinyurl.com/3xzuxb7
1.2.4 การหาค่าประจุของอิเล็กตรอน
ใน พ.ศ. 2451 โรเบิร์ต แอนดูรส์ มิลลิแกน (Robert Andrews Millikan) นักวิทยาศาสตร์ชาวอเมริกันได้ทำการทดลองหาค่าประจุของอิเล็กตรอนโดยใช้การทดลองที่เรียกว่า “Oil drop Experiment ”
เครื่องมือประกอบด้วยขั้วไฟฟ้า 2 ขั้ว ต่ออยู่กับเครื่องกำเนิดไฟฟ้า ขั้วไฟฟ้าบนเป็นขั้วบวก และขั้วไฟฟ้าด้านล่างเป็นขั้วลบ ขั้วไฟฟ้าทั้ง 2 ใส่ไว้ในกล่องมีอากาศอยู่ภายใน
เมื่อพ่นหยดน้ำมันเม็ดเล็ก ๆ เข้าไประหว่าง ขั้วไฟฟ้าทั้งสอง เนื่องจากน้ำมันแต่ละหยดมีมวล ดังนั้นจึงถูกแรงดึงดูดของโลกทำให้ตกลงมาสู่ด้านล่าง
ในขณะที่เม็ดน้ำมันยังไม่มีประจุไฟฟ้า การที่จะบังคับให้เคลื่อนที่ขึ้นลงจึงยังทำไม่ได้ ดังนั้นในตอนแรกจึงต้องเติมประจุลงบนหยดน้ำมันก่อนโดยการฉายรังสีเอ็กซ์ (X-ray) เข้าไป รังสีเอ็กซ์จะไปชนกับอากาศในกล่อง ทำให้อะตอมของอากาศเกิดการแตกตัว
รูปที่ 9 การทดลอง Oil drop Experiment
ที่มา : Ebbing and Gammon (2007 : 45)
ในปี พ.ศ. 2454 รัทเทอร์ฟอร์ด ได้ทำการทดลองในประเทศอังกฤษร่วมกับ ฮันส์ ไกเกอร์ และ เออร์เนสต์ มาร์สเตน ศึกษาทิศทางการเคลื่อนที่ของอนุภาคแอลฟา เมื่อยิงอนุภาคแอลฟาซึ่งได้จากการสลายตัวของสารกัมมันตรังสีเข้าไปที่แผ่นทองคำบาง ๆ ดังรูปที่ 10
รูปที่ 10 การทดลองของรัทเทอร์ฟอร์ด
ที่มา : Ebbing and Gammon (2007 : 46)
การตรวจสอบทิศทางการ เคลื่อนที่ของอนุภาคหลังจากกระทบแผ่นทองคำแล้ว ทำได้โดยใช้ฉากเรืองแสงขดเป็นวงกลมล้อมรอบแผ่นทองคำไว้ โดยเว้นที่เฉพาะบริเวณที่จะให้อนุภาคแอลฟาผ่านเข้ามาเท่านั้น ทุก ๆ ครั้งที่อนุภาคแอลฟากระทบฉากเรืองแสงจะพบว่ามีจุดสว่าง เกิดขึ้นที่ฉากเรืองแสงนั้น(อนุภาคแอลฟาคือนิวเคลียสของธาตุฮีเลียม ซึ่งมีประจุบวก ดังนั้นเมื่อกระทบฉากเรืองแสงจึงมีจุดสว่างเกิดขึ้น ทำให้ทราบทิศทางการเคลื่อนที่ของอนุภาคแอลฟา) จากการทดลองพบว่าอนุภาคแอลฟาส่วนใหญ่จะวิ่งเป็นแนวเส้นตรงผ่านแผ่นทองคำไปกระทบฉากเรืองแสงซึ่งก็คือบริเวณจุด ก ที่อยู่หลังแผ่นทองคำบางส่วนจะเบี่ยงเบนไปจากแนวเส้นตรง คือบริเวณจุด ข ของฉากเรืองแสง และมีน้อยครั้งมากที่อนุภาคสะท้อนกลับมากระทบฉากเรืองแสงที่จุด ค ซึ่งอยู่หน้าแผ่นทองคำ
จากผลการทดลองทำให้รัทเทอร์ฟอร์ดแปลกใจมาก เพราะถ้านำแบบจำลองอะตอมของทอมสันอธิบายทิศทางที่น่าจะเกิดขึ้น เมื่อยิงอนุภาคแอลฟาไปที่แผ่นทองคำ อนุภาคส่วนใหญ่ควรจะเบี่ยงเบนไปจากแนวเส้นตรง ทั้งเพราะตามแบบจำลองอะตอมของทอมสัน อะตอมประกอบด้วยอนุภาคบวก และลบ กระจายอยู่ทั่วไปในอะตอม เมื่อยิงอนุภาคแอลฟาซึ่งมีประจุบวกเข้าไปในอะตอมของแผ่นทองคำ อนุภาคแอลฟาควรจะผลักกับโปรตอนซึ่งมีประจุบวกเหมือนกัน อันจะเป็นผลทำให้ทิศทางของอนุภาคแอลฟาเบี่ยงเบนดังในรูป แต่จากผลการทดลอง การที่อนุภาคแอลฟาส่วนใหญ่วิ่งผ่านทองคำเป็นแนวเส้นตรงจึงทำให้รัทเทอร์ฟอร์ดแปลกใจมาก โดยเฉพาะอนุภาคแอลฟาส่วนที่สะท้อนกลับยิ่งทำให้แปลกใจมากยิ่งขึ้น ทั้งนี้เพราะการที่อนุภาคแอลฟาสะท้อนกลับได้แสดงว่าภายในอะตอมจะต้องมีสิ่งที่มีมวลมากขวางทางอยู่ เมื่ออนุภาคแอลฟาไปชนจึงเกิดการสะท้อนกลับ แต่จากแบบจำลองอะตอมของทอมสันภายในอะตอม ไม่มีสิ่งหนึ่งสิ่งใดอยู่รวมกันเป็นกลุ่มก้อนเลย ดังนั้นการสะท้อนกลับของอนุภาคแอลฟาเป็นมุมมากกว่า 90 องศา จึงไม่มีทางเกิดขึ้นได้ จากการที่แบบจำลองของทอมสันไม่สามารถอธิบายผลการทดลองได้ ทำให้รัทเทอร์ฟอร์ดคิดว่าแบบจำลองอะตอมของทอมสันยังไม่ถูกต้อง จึงเสนอแบบจำลองอะตอมใหม่ขึ้นมาเพื่อใช้อธิบายผลการทดลองดังกล่าว
รูปที่ 11 แบบจำลองที่สร้างขึ้นเพื่อการอธิบายของรัทเทอร์ฟอรด์
ที่มา : Ebbing and Gammon (2007 : 47)
การที่อนุภาคแอลฟาส่วนใหญ่เคลื่อนที่ผ่านอะตอมของทองคำเป็นแนวเส้นตรง แสดงว่าภายในอะตอมทองคำควรจะมีที่ว่างเป็นจำนวนมาก และการที่อนุภาคแอลฟาบางส่วนสะท้อนกลับแสดงว่าภายในอะตอมควรจะมีอนุภาคอะไรสักอย่างที่รวมกันเป็นกลุ่มก้อน และมีปริมาณมากพอ รวมทั้ง มีมวลมากพอที่จะทำให้อนุภาคสะท้อนกลับเมื่อกระทบถูกได้ เนื่องจากภายในอะตอม(ในขณะนั้น) มีแต่อิเล็กตรอน และโปรตอน โดยที่อิเล็กตรอนมีมวลน้อยมาก รัทเทอร์ฟอร์ดจึงคิดว่าอนุภาคส่วนที่มารวมกันเป็นกลุ่มก้อนจึงน่าจะเป็นอนุภาคของโปรตอน ดังนั้นเพื่อที่จะอธิบายผลการทดลอง รัทเทอร์ฟอร์ดจึงเสนอแบบจำลองแบบใหม่ เรียกว่าแบบจำลองอะตอมของรัทเทอร์ฟอร์ด ดังนี้
“อะตอมมีลักษณะเป็นทรงกลม ประกอบด้วยนิวเคลียสซึ่งคือโปรตอนที่รวมกันอยู่ตรงกลางของอะตอม และมีอิเล็กตรอนวิ่งอยู่รอบ ๆ นิวเคลียส นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุบวก ส่วนอิเล็กตรอนจะมีมวลน้อยและมีประจุลบ จำนวนอิเล็กตรอนจะเท่ากับจำนวนโปรตอน”
จากแบบจำลองอะตอมตามมโนภาพของรัทเทอร์ฟอร์ดจะเห็นได้ว่า อะตอมถูกแบ่งเป็น 2 ส่วน ส่วนหนึ่งคือนิวเคลียส ซึ่งอยู่ตรงกลางอะตอม มีขนาดเล็กมากเมื่อเปรียบเทียบกับขนาดอะตอม อีกส่วนหนึ่งคืออิเล็กตรอนที่วิ่งอยู่รอบ ๆ นิวเคลียส ลักษณะของอะตอมจึงเป็นแบบโปร่ง ภายในอะตอมมีช่องว่างอยู่มาก
รูปที่ 12 ภาพที่เกิดจากการสรุปผลการทดลองของรัทเทอร์ฟอร์ด
ที่มา : http://tinyurl.com/3xzuxb7
จากแบบจำลองอะตอมตามมโนภาพของรัทเทอร์ฟอร์ดจะเห็นได้ว่าอะตอมถูกแบ่งเป็น 2 ส่วน
ส่วนที่หนึ่งคือนิวเคลียส ซึ่งอยู่ตรงกลางอะตอม มีขนาดเล็กมากเมื่อเปรียบเทียบกับขนาดอะตอม อีกส่วนหนึ่งคืออิเล็กตรอนที่วิ่งอยู่รอบ ๆ นิวเคลียส ลักษณะของอะตอมจึงเป็นแบบโปร่ง ภายในอะตอมมีช่องว่างอยู่มาก
รัทเทอร์ฟอร์ดได้ใช้แบบจำลองอะตอมที่เสนอขึ้นใหม่อธิบายผลการทดลองดังนี้ เนื่องจากนิวเคลียสมีขนาดเล็กมาก เมื่อเปรียบเทียบกับขนาดของอะตอม ทำให้มีช่องว่างภายในอะตอมมาก เมื่อยิงอนุภาคแอลฟาเข้าไปอนุภาคส่วนใหญ่จึงสามารถวิ่งทะลุผ่านแผ่นทองคำไปได้โดยไม่มีการเบี่ยงเบน
มีบางครั้งอนุภาคแอลฟาวิ่งเข้ามาใกล้นิวเคลียสซึ่งมีประจุบวกเหมือนกันจะถูกนิวเคลียสผลักออกไป ซึ่งทำให้ทิศทางของอนุภาคแอลฟาเบี่ยงเบนออกไปและนาน ๆ ครั้ง อนุภาคแอลฟาจะวิ่งตรงไปชนกับนิวเคลียสทำให้สะท้อนกลับออกมา แต่เนื่องจากนิวเคลียสมีขนาดเล็กมากเกินไป ดังนั้นโอกาสที่อนุภาคแอลฟาจะชนกับนิวเคลียสจึงน้อยมาก ๆ สำหรับอิเล็กตรอนที่วิ่งอยู่รอบ ๆ นิวเคลียสเนื่องจากมีมวลน้อยมาก ถึงแม้ว่าอนุภาคแอลฟาจะวิ่งมาชนก็จะไม่มีผลทำให้ทิศทางการเคลื่อนที่ของอนุภาคแอลฟาเบี่ยงเบนไป
จะเห็นว่าแบบจำลองอะตอมที่รัทเทอร์ฟอร์ดเสนอขึ้นมาใหม่นี้สามารถอธิบายผลการทดลองได้เป็นอย่างดี และตามมโนภาพของรัทเทอร์ฟอร์ด มวลส่วนใหญ่ของอะตอมก็คือมวลของนิวเคลียสนั่นเอง อิเล็กตรอนแม้ว่าจะเป็นส่วนประกอบที่ทำให้อะตอมมีขนาดใหญ่ขึ้นจะมีมวลน้อยมากซึ่งจะไม่มีผลต่อมวลของอะตอม
อย่างไรก็ตามถึงแม้ว่าแบบจำลองอะตอมของรัทเทอร์ฟอร์ดสามารถใช้อธิบายผลการทดลองได้ถูกต้องกว่าแบบจำลองอะตอมของทอมสัน แต่ก็ยังมีข้อบกพร่องที่ยังไม่สามารถอธิบายได้ เช่น ทำไมโปรตอนซึ่งมีประจุบวกเหมือนกัน จึงรวมกันอยู่ตรงกลางเป็นนิวเคลียสได้ ทั้ง ๆ ที่ควรจะผลักกัน มีอะไรมายึดโปรตอนให้อยู่รวมกันได้ และทำไมอิเล็กตรอนที่วิ่งอยู่รอบ ๆ นิวเคลียสจึงไม่ผลักกัน ทั้ง ๆ ที่มีประจุลบเหมือนกัน รวมทั้งทำไมจึงไม่ถูกดึงดูดเข้าไปที่นิวเคลียส ซึ่งเป็นเหตุที่ต้องมีการปรับปรุงและเสนอแบบจำลองอะตอมใหม่ ๆ ขึ้นมา
1.3.1 อนุภาคมูลฐานของอะตอม
จากการศึกษาเกี่ยวกับโครงสร้างอะตอมในตอนแรก ทำให้นักวิทยาศาสตร์เชื่อว่าอะตอมประกอบด้วยอนุภาค 2ชนิด คือ อิเล็กตรอน และโปรตอน จนกระทั่งการศึกษาเกี่ยวกับอะตอมได้พัฒนาการมากขึ้น จึงได้ทราบว่านอกจากจะมีอิเล็กตรอน และโปรตอนแล้วยังมีนิวตรอนและอนุภาค อื่น ๆ อีกหลายชนิด
ในปี พ.ศ. 2456 เฮนรี มอสเลย์ (Henry Mosley) นักวิทยาศาสตร์
ในปี พ.ศ. 2456 เฮนรี มอสเลย์ (Henry Mosley) นักวิทยาศาสตร์
สเปกตรัมรังสีเอกซ์ของธาตุ เมื่อนำจำนวนโปรตอนของธาตุมาพิจารณาร่วมกับ
แบบจำลองอะตอมของรัทเทอร์ฟอร์ดในแง่มวลของอะตอม จะพบว่าแบบจำลอง
อะตอมของรัทเทอร์ฟอร์ดยังไม่ถูกต้องนัก กล่าวคือตามแบบจำลองอะตอมของรัทเทอร์ฟอร์ด มวลของอะตอมก็คือมวลของนิวเคลียส หรือมวลของโปรตอน อย่างเดียวนั่นเอง ถ้านิวเคลียสของอะตอมประกอบด้วยโปรตอนอย่างเดียว มวลอะตอมก็น่าจะเท่ากับมวลของโปรตอนมารวมกัน แต่จากการทดลองหามวลของอะตอมพบว่ามวลอะตอมของธาตุต่าง ๆ มักจะมีค่ามากกว่ามวลของโปรตอนเสมอ เช่น ธาตุคาร์บอนมีโปรตอน 6 ตัว ตามแบบจำลองของรัทเทอร์ฟอร์ดมวลอะตอมควรจะมีค่าเป็น 6 หน่วย แต่จากการทดลองพบว่ามีมวลอะตอมถึง 12 หน่วย หรือธาตุออกซิเจนมี 8 โปรตอน แต่มีมวลอะตอม 16 หน่วย เป็นต้น
จากผลการทดลองพบว่าอะตอมของธาตุส่วนใหญ่จะมีมวลเป็น 2 เท่า หรือมากกว่า 2 เท่า หรือมากกว่า 2 เท่าของโปรตอน ทำให้รัทเทอร์ฟอร์ดตั้งข้อสันนิษฐานว่า ภายในอะตอมน่าจะมีอนุภาคหนึ่งซึ่งไม่ใช่โปรตอน และอิเล็กตรอนอยู่ด้วย โดยที่อนุภาคนี้จะอยู่รวมกันในนิวเคลียส และมีมวลใกล้เคียงกับมวลของโปรตอน รวมทั้งเป็นกลางทางไฟฟ้าด้วย ซึ่งต่อมาก็ได้มีการพิสูจน์ข้อสันนิษฐานของรัทเทอร์ฟอร์ด จนยอมรับกันว่าเป็นความจริง
ประมาณปี พ.ศ. 2456 ทอมสันได้ทดลองเกี่ยวกับมวลของอนุภาคบวกที่ได้
 จากหลอดรังสีแคโทดพบว่าในขณะที่ใช้แก๊สนีออนใส่ในหลอดรังสีจะสามารถหามวลของอนุภาคบวกได้ถึง 2 ค่า คือ 20 และ 22 หน่วย ซึ่งแสดงว่าแก๊สนีออนจะต้องมีอะตอม 2 ชนิด ซึ่งมีมวลไม่เท่ากัน ซึ่งต่อมา เฟรเดอริก ซอดดี(Frederick Soddy) ได้ตั้งชื่ออะตอมของธาตุชนิดเดียวกันแต่มีมวลต่างกันว่าต่างกันว่า ไอโซโทป ซึ่งถือว่าผลการทดลองนี้เป็นข้อมูลสนับสนุนข้อเสนอ ของรัทเทอร์ฟอร์ดที่ว่าภายในนิวเคลียสควรจะมีอนุภาคอีกอย่างหนึ่งซึ่งมีมวลใกล้เคียงกับโปรตอน แต่ไม่มีประจุ
จากหลอดรังสีแคโทดพบว่าในขณะที่ใช้แก๊สนีออนใส่ในหลอดรังสีจะสามารถหามวลของอนุภาคบวกได้ถึง 2 ค่า คือ 20 และ 22 หน่วย ซึ่งแสดงว่าแก๊สนีออนจะต้องมีอะตอม 2 ชนิด ซึ่งมีมวลไม่เท่ากัน ซึ่งต่อมา เฟรเดอริก ซอดดี(Frederick Soddy) ได้ตั้งชื่ออะตอมของธาตุชนิดเดียวกันแต่มีมวลต่างกันว่าต่างกันว่า ไอโซโทป ซึ่งถือว่าผลการทดลองนี้เป็นข้อมูลสนับสนุนข้อเสนอ ของรัทเทอร์ฟอร์ดที่ว่าภายในนิวเคลียสควรจะมีอนุภาคอีกอย่างหนึ่งซึ่งมีมวลใกล้เคียงกับโปรตอน แต่ไม่มีประจุปี พ.ศ. 2475 เจมส์ แซควิก (James Chadwick) นักวิทยาศาสตร์ชาวอังกฤษ ได้ทดลองยิงอนุภาคแอลฟาไปยังธาตุชนิดต่างๆ โดยใช้
 เครื่องมือที่ละเอียดถูกต้องยิ่งขึ้น และพิสูจน์ได้ว่าภายในนิวเคลียสจะมี
เครื่องมือที่ละเอียดถูกต้องยิ่งขึ้น และพิสูจน์ได้ว่าภายในนิวเคลียสจะมี
อนุภาคอีกชนิดหนึ่งซึ่งเป็นกลางทางไฟฟ้าอยู่ด้วย และเรียกอนุภาคนั้นว่านิวตรอน จากการค้นพบนิวตรอน จึงทำให้โครงสร้างของอะตอมเปลี่ยนแปลงไปจากแบบจำลองอะตอมของรัทเทอร์ฟอร์ดเล็กน้อยทำให้ทราบว่าภายในอะตอมจะประกอบด้วยอนุภาค 3 ชนิด คือ อิเล็กตรอน
โปรตอน และ นิวตรอน โดยเรียกอนุภาคทั้ง 3 ชนิดว่าเป็นอนุภาคมูลฐานของอะตอม ดังนั้นแบบจำลองอะตอมจึงเปลี่ยนไป ซึ่งมีลักษณะดังนี้
ในปัจจุบันนอกจากจะพบอนุภาคมูลฐานของอะตอมซึ่งจัดว่าเป็นอนุภาคที่มีความคงตัวภายในอะตอมแล้วยังมีอนุภาคอื่น ๆ อีกหลายชนิดที่อยู่ภายในอะตอม แต่เป็นอนุภาคที่ไม่คงตัว ซึ่งอาจจะเกิดจากนิวเคลียสของอะตอมถูกชนด้วยอนุภาคอื่น ๆ ตัวอย่างของอนุภาคที่ไม่คงตัว ได้แก่ โพสิตรอน (Positron) ที่เกิดในปฏิกิริยานิวเคลียร์มีมวลน้อยมากจนเกือบเป็นศูนย์ และมีชอน (Meson) ซึ่งมีมวลอยู่ระหว่างโปรตอนกับอิเล็กตรอนและเชื่อกันว่ามีส่วนช่วยให้โปรตอนและนิวตรอนสามารถยึดเหนี่ยวอยู่ด้วยกันได้ภายในนิวเคลียส "อะตอมมีลักษณะเป็นทรงกลม ประกอบด้วยโปรตอนและนิวตรอนรวมอยู่ตรงกลางของอะตอม เรียกว่า นิวเคลียส และมีอิเล็กตรอนซึ่งมีจำนวนเท่ากับโปรตอนวิ่งอยู่รอบ ๆ นิวเคลียส”
ในปัจจุบันนอกจากจะพบอนุภาคมูลฐานของอะตอมซึ่งจัดว่าเป็นอนุภาคที่มีความคงตัวภายในอะตอมแล้วยังมีอนุภาคอื่น ๆ อีกหลายชนิดที่อยู่ภายในอะตอม แต่เป็นอนุภาคที่ไม่คงตัว ซึ่งอาจจะเกิดจากนิวเคลียสของอะตอมถูกชนด้วยอนุภาคอื่น ๆ ตัวอย่างของอนุภาคที่ไม่คงตัว ได้แก่ โพสิตรอน (Positron) ที่เกิดในปฏิกิริยานิวเคลียร์มีมวลน้อยมากจนเกือบเป็นศูนย์ และมีชอน (Meson) ซึ่งมีมวลอยู่ระหว่างโปรตอนกับอิเล็กตรอนและเชื่อกันว่ามีส่วนช่วยให้โปรตอนและนิวตรอนสามารถยึดเหนี่ยวอยู่ด้วยกันได้ภายในนิวเคลียส "อะตอมมีลักษณะเป็นทรงกลม ประกอบด้วยโปรตอนและนิวตรอนรวมอยู่ตรงกลางของอะตอม เรียกว่า นิวเคลียส และมีอิเล็กตรอนซึ่งมีจำนวนเท่ากับโปรตอนวิ่งอยู่รอบ ๆ นิวเคลียส”
รูปที่ 13 แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ที่มา : http://tinyurl.com/3xoynrn
จากการศึกษาสมบัติของอนุภาคมูลฐานของอะตอมทั้ง 3 ชนิด พบว่าอิเล็กตรอนแต่ละตัวมีประจุเท่ากับโปรตอน แต่เป็นประจุตรงกันข้าม คืออิเล็กตรอนมีประจุลบ แต่โปรตอนมีประจุบวก ในขณะที่นิวตรอนเป็นกลางทางไฟฟ้า คือประจุเป็นศูนย์ นอกจากนี้ยังทราบว่ามวลของโปรตอนและนิวตรอนมีค่าใกล้เคียงกันมาก ส่วนมวลของอิเล็กตรอนมีค่าน้อยมากเมื่อเปรียบเทียบกับโปรตอน ดังตารางที่ 1
1.3.2 เลขอะตอม เลขมวล และ ไอโซโทป
จากการค้นพบนิวตรอนทำให้ทราบว่าแบบจำลองอะตอมประกอบด้วยอนุภาคมูลฐาน 3 ชนิด คือ อิเล็กตรอน โปรตอน และนิวตรอน เพื่อความสะดวกในการเขียนโครงสร้างของอะตอม นักวิทยาศาสตร์จึงได้กำหนดสัญลักษณ์ต่าง ๆ แทนอนุภาคมูลฐานเหล่านั้นขึ้นมา คือเลขอะตอม และเลขมวลของธาตุ
1.3.2.1 เลขอะตอม (Atomic number)
เลขอะตอม หมายถึง ตัวเลขที่แสดงจำนวนโปรตอนที่มีอยู่ในนิวเคลียสของธาตุ โดยทั่วไปใช้สัญลักษณ์Z
อะตอมของธาตุชนิดหนึ่ง ๆ จะมีจำนวนโปรตอนเฉพาะตัวไม่ซ้ำกับธาตุอื่น ๆ ธาตุชนิดเดียวกันจะต้องมีจำนวนโปรตอนหรือเลขอะตอมเท่ากัน
ถ้าอะตอมเป็นกลาง จำนวนอิเล็กตรอน เท่ากับ จำนวนโปรตอน
ดังนั้น เลขอะตอม = จำนวนโปรตอน = จำนวนอิเล็กตรอน
แต่ถ้าอะตอมไม่เป็นกลาง จำนวนอิเล็กตรอนจะไม่เท่ากับโปรตอน เช่น
-ไอออนบวกจะมีโปรตอนมากกว่าอิเล็กตรอน
-ไอออนลบจะมีโปรตอนน้อยกว่าอิเล็กตรอน
นั่นคือ เลขอะตอม = จำนวนโปรตอน ไม่เท่ากัน จำนวนอิเล็กตรอน
1.3.2.2 เลขมวล (Mass number) ใช้สัญลักษณ์เป็น A หมายถึง ผลรวมของจำนวนโปรตอน และจำนวนนิวตรอนในนิวเคลียส เลขมวลไม่ใช่มวลอะตอม เลขมวลจะต้องเป็นจำนวนเต็มเสมอ แต่มวลอะตอมอาจจะเป็นเลขจำนวนเต็มหรือไม่ก็ได้
ถ้าให้ n = จำนวนนิวตรอน
จะสามารถหาความสัมพันธ์ระหว่างเลขอะตอม เลขมวล และจำนวนนิวตรอนได้ดังนี้

ธาตุที่เป็นไอโซโทปกัน ถึงแม้จะเป็นธาตุชนิดเดียวกัน แต่มวลอะตอมจะไม่เท่ากัน รวมทั้งสมบัติทางกายภาพแตกต่างกันด้วย แต่สมบัติทางเคมีเกือบเหมือนกันทุกประการ
ธาตุชนิดหนึ่ง ๆ อาจจะมีได้หลายไอโซโทป บางไอโซโทปมีอยู่ในธรรมชาติแต่บางไอโซโทปก็สังเคราะห์ขึ้นมาทั้งนี้เพื่อนำไปใช้ประโยชน์ในแง่ต่าง ๆ กัน ไอโซโทปของธาตุชนิดหนึ่ง ๆ มักจะมีปริมาณในธรรมชาติไม่เท่ากัน เช่น ธาตุไฮโดรเจนในธรรมชาติจะมีโปรเทรียม อยู่ถึง 99.99% ดังนั้น จึงมีดิวทีเรียมเพียงเล็กน้อย ส่วนทริเทรียม เป็นไอโซโทปกัมมันตรังสีจึงไม่เสถียร
1.4 แบบจำลองอะตอมของโบร์
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด กล่าวถึงอิเล็กตรอนวิ่งรอบ ๆ นิวเคลียส แต่ไม่ทราบว่าอิเล็กตรอนอยู่รอบ ๆ นิวเคลียสมีการจัดเรียงอิเล็กตรอนอย่างไร นักวิทยาศาสตร์จึงมีการศึกษาข้อมูลใหม่มาสร้างแบบจำลอง ที่เน้นรายละเอียดเกี่ยวกับการจัดเรียงอิเล็กตรอนที่อยู่รอบนิวเคลียส โดยศึกษาจากสเปกตรัมและค่าพลังงานไอออไนเซชัน
1.4.1 สเปกตรัม
สเปกตรัมเป็นแสงที่ถูกแยกกระจายออกเป็นแถบสีต่าง ๆ และแสงเป็นรูปหนึ่งของคลื่นแม่เหล็กไฟฟ้า ฉะนั้น เพื่อความเข้าใจจำเป็นต้องรู้เกี่ยวกับส่วนประกอบของคลื่นและพลังงานคลื่นแม่เหล็กไฟฟ้าเสียก่อนแล้วนำความรู้เรื่อง ดังกล่าวมาใช้ในการวิเคราะห์สเปกตรัมได้
1.4.2 ส่วนประกอบของคลื่น
1) สันคลื่นหรือยอดคลื่น คือตำแหน่งสุงสุดของคลื่น ในภาพ คือตำแหน่ง ก และ ข
2) ท้องคลื่น คือตำแหน่งที่ต่ำสุดของคลื่น ในภาพคือตำแหน่ง ค 3) ความยาวคลื่นใช้สัญลักษณ์แลมป์ดา คือระยะทางที่คลื่นเคลื่อนที่ครบ 1 รอบ ในภาพคือ ตำแหน่ง ก ถึง ข ความยาวคลื่นมีหน่วยเป็นเมตรหรือมีหน่วยเป็นนาโนเมตร (nm) ก็ได้โดย 1 นาโนเมตร = 10-9 เมตร
รูปที่ 13 แสดงความยาวของคลื่น
ที่มา : Ebbing and Gammon (2007 : 265)
4) ความถี่ใช้สัญลักษณ์ n (อ่านว่านิว) คือจำนวนรอบที่คลื่นเคลื่อนที่ผ่านจุดหนึ่งในเวลา
1 วินาที ความถี่มีหน่วยเป็น รอบ/วินาที (s-1) หรือ (Hz)
รูปที่ 14 แสดงความถี่ของคลื่น
ที่มา : Ebbing and Gammon (2007 : 265)
5) แอมปริจูดคือความสูงของคลื่นซึ่งประกอบด้วยคลื่นที่มีความถี่และความยาวคลื่น
ต่าง ๆ กันเป็นช่วงกว้าง มีทั้งช่วงความยาวคลื่นที่มองเห็นและความยาวคลื่นที่มองไม่เห็น ดังรูป
รูปที่ 15 แสดงแอมปริจูดคลื่นแม่เหล็กไฟฟ้า
ที่มา : Kotz , Treichel, and Weaver, (2005 : 299)
เมื่อนำแสงขาวที่เกิดจากดวงอาทิตย์ส่องผ่านปริซึมหรือเกรตติง แสงสีขาวจะแยกเป็นสีต่างๆ ต่อเนื่อง ซึ่งเรียกว่า แถบสเปกตรัม ดังรูปที่ 16
ตารางที่ 2 แสดงสีต่าง ๆ ในแถบสเปกตรัมของแสง
รูปที่ 16 แสงสีต่าง ๆ ในแถบสเปกตรัมของแสงขาว (แสงอาทิตย์)
ที่มา : Kotz , Treichel, and Weaver, (2005 : 306)
การที่แสงขาวผ่านปริซึมหรือเกรตติง แล้วแยกออกเป็นแสงสีต่าง ๆ อธิบายได้ว่า แสงสีขาวเดินทางจากอากาศผ่านตัวกลางชนิดใหม่คือ ปริซึมก็จะเกิดการหักเห และกระจายออกเป็นแสงสีต่าง ๆ ตามความยาวคลื่นของแสงนั้น ๆ โดยแสงที่มีความยาวคลื่นมากจะหักเหน้อยกว่าแสงที่มีความยาวน้อย
ดังตารางที่ 2
ที่มา : กระทรวงศึกษาธิการ (2550 : 18)
จากตารางที่ 2 พบว่า แสงสีม่วงมีความยาวคลื่นน้อยที่สุด จะหักเหได้มากที่สุด แสงสีแดงมีความยาวคลื่นมากที่สุดจะหักเหได้น้อยที่สุด สำหรับคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นในช่วงอื่น ๆ ก็มีการหักเหเมื่อผ่านปริซึมได้เช่นเดียวกันแต่ไม่สามารถมองเห็นได้เหมือนแสงสีขาว
มักซ์ พลังค์ (Max Planck, 1858-1947) นักวิทยาศาสตร์ยาวเยอรมัน ได้ศึกษาพลังงานของคลื่นแม่เหล็กไฟฟ้า และสรุปว่าพลังงานของคลื่นแม่เหล็กไฟฟ้าจะเป็นวัดส่วนโดยตรงกับความถี่ของคลื่นนั้น โดยเขียนความสัมพันธ์ได้ดังนี้ (Kotz , Treichel, and Weaver, 2005 : 302)
E = hV ................................(1)
เมื่อ E คือ พลังงานมีหน่วยเป็นจูล (J)
h คือ ค่าคงที่ของพลังค์ มีค่า 6.626 x 10-34 จูล.วินาที (J.s)
n คือ ความถี่ของคลื่นแม่เหล็กไฟฟ้ามีหน่วยเป็นเฮิร์ตซ์ (s-1)
ในการศึกษาเกี่ยวกับคลื่นโดยทั่วไป มักจะวัดเป็นความยาวคลื่น เมื่อทราบความยาวคลื่นก็คำนวณความถี่ได้จากความสัมพันธ์ ดังนี้ (Kotz , Treichel, and Weaver, 2005 : 297)

4. เส้นสเปกตรัมของธาตุและสารประกอบ
ถ้าเปรียบเทียบสเปกตรัมของแสงอาทิตย์ และแสงจากหลอดฟลูออเรสเซนต์ จะพบว่าสเปกตรัมที่เห็นจากแสงอาทิตย์
มีลักษณะเป็นแบบต่อเนื่องกัน เรียกว่าแถบสเปกตรัม ส่วนสเปกตรัมที่ได้จากแสงของหลอดฟลูออเรสเซนต์นั้นจะเห็นแถบสเปกรัม
ของแสงขาวจากดวงอาทิตย์เป็นพื้นแล้ว ยังเห็นสเปกตรัมสีเขียวปรากฎอย่างชัดเจนอยุ่บนแถบสเปกตรัมสีเขียวอย่างชัดเจน
ซึ่งสเปกตรัมที่เห็นนี้เป็นสเปกตรัมที่เกิดจากธาตุที่บรรจุในหลอดฟลูออเรสเซนต์
เมื่อนำธาตุหรือสารประกอบเผาจะได้แสงไฟของธาตุออกมาเรียกว่าเปลวไฟธาตุ ซึ่งเกิดจากส่วนที่เป็นไอออนของโลหะ
เมื่อใช้สเปกโทรสโคป หรือเกรตติงส่องดูเปลวไฟจะมีสีปรากฎเป็นเส้น ๆ หลายสี เรียกว่าเส้นสเปกตรัม ฉะนั้นการวิเคราะห์ธาตุองค์ประกอบทำได้โดย
1. วิเคราะห์จากเปลวไฟของธาตุ
1.1 ถ้าสารประกอบที่มีธาตุองค์ประกอบเป็นโลหะชนิดเดียวกันจะให้สีของเปลวไฟธาตุเหมือนกัน
1.2 ถ้าสารประกอบที่มีธาตุองค์ประกอบเป็นโลหะต่างชนิดกันจะให้สีของเปลวไฟธาตุต่างกัน
ดังรูปที่ 17
อย่างไรก็ตามการใช้เปลวไฟวิเคราะห์ธาตุจะไม่ชัดเจนเท่ากับการใช้สเปกตรัม เพราะ
1) เปลวไฟที่เกิดจากการเผาสาร มักเห็นสีที่ปรากฏเด่นชัดที่สุดเพียงสีเดียว
2) ถ้านำสารประกอบของโลหะสองชนิดผสมกัน แล้วนำไปเผาจะได้สีของเปลวไฟเป็นสีผสม
ซึ่งตาไม่สามารถแยกสี เหล่านั้นได้
2. วิเคราะห์จากเส้นสเปกตรัม
เมื่อนำสารประกอบของโลหะแต่ละชนิด นำมาเผาจะให้สีเปลวไฟของธาตุแตกต่างไปตามชนิดของโลหะ การดูสีเปลวไฟมักมองด้วยตาเปล่าเห็นเพียงสีเดียวที่เป็นสีเด่นชัดที่สุด แต่ถ้าส่องดู
ด้วยสเปกโทรสโคปหรือเกรตติง จะพบว่า สีของเปลวไฟจะแยกออกเป็นเส้น ๆ หลายสี แต่มีสีที่เด่นชัดเพียงสีเดียว คือเส้นสเปกตรัมที่มีสีเหมือนเปลวไฟ ดังตัวอย่างการศึกษาเส้นสเปกตรัมของสารประกอบและธาตุต่อไปนี้
1. ถ้านำ CaCl2 และ CaSO4 มาเผาให้เปลวไฟสีแดงอิฐ เส้นสเปกตรัมที่เห็นชัดเจนมีสีแดงเข้มหรือ BaCl2 และ BaNO3 จะให้เปลวไฟสีเขียวอมเหลือง เมื่อส่องดูเปลวไฟด้วยสเปกโทรสโคปจะเห็นเส้นสเปกตรัมสีเขียวชัดเจน แสดงว่าสีของเปลวไฟและเส้นสเปกตรัมเกิดจากส่วนที่เป็นโลหะ แต่อโลหะก็ให้เส้นสเปกตรัมที่อยู่ในช่วงความถี่ที่ตาเรามองไม่เห็น
2. การศึกษาสเปกตรัมของธาตุที่อยู่ในสถานะก๊าซทำได้โดยการผ่านกระแสไฟฟ้าที่มีความต่างศักย์สูงเข้าสู่หลอดแก้วที่บรรจุก๊าซที่มีความดันต่ำ เมื่อก๊าซได้รับพลังงานจะส่องแสงเป็นสีต่าง ๆ ตามชนิดของก๊าซ ถ้าก๊าซชนิดเดียวกันจะให้เส้นสเปกตรัมเหมือนกัน และต่างจากเส้นสเปกตรัมของก๊าซอื่น
การวิเคราะห์ธาตุจากเส้นสเปกตรัม ถ้าเป็นโลหะชนิดเดียวกันไม่ว่าจะอยู่ในรูปธาตุหรือสารประกอบจะมีลักษณะเหมือนกันทั้งในแง่ของจำนวนเส้นสเปกตรัม สีของแต่ละเส้นและตำแหน่งของเส้นสเปกตรัม ส่วนสเปกตรัมของโลหะต่างชนิดกันจะไม่เหมือนกัน ถึงแม้บางครั้งอาจมีสีของเส้นสเปกตรัมเหมือนกัน ตำแหน่งของเส้นสเปกตรัมจะต่างกัน แสดงว่าธาตุแต่ละชนิดให้ชุดสเปกตรัมไม่ซ้ำกัน
5. อธิบายการเกิดสเปกตรัม
จากการทดลองเผาสารประกอบของโลหะให้เปลวไฟสีต่างๆ กันตามชนิดของโลหะ จึงทำให้เกิดความคิดที่ว่าโลหะน่าจะมีส่วนที่รับพลังงานความร้อนเข้าไป แล้วเปลี่ยนพลังงานความร้อนให้เป็นพลังงานแสง การที่โลหะต่างชนิดกัน ให้สีต่างกันนั้นอาจจะเป็นไปได้ว่าโลหะแต่ละชนิดคายพลังงานความร้อนออกมาได้ไม่เท่ากัน ความถี่และความยาวคลื่นแตกต่างกัน ตามกฎของพลังค์ ดังนั้นการอธิบายการเกิดสเปกตรัมจึงตั้งอยู่ในสมมุติฐานที่ว่า อะตอมน่าจะมีส่วนที่รับและคายพลังงาน จากแบบจำลองอะตอมของรัทเทอร์ฟอร์ด นักเรียนทราบมาแล้วว่า อิเล็กตรอนจะวิ่งรอบ ๆ นิวเคลียส ดังนั้นส่วนที่จะรับและคายพลังงานได้ ควรเป็นอิเล็กตรอน โดยอิเล็กตรอนจะเคลื่อนที่อยู่ในบริเวณที่มีผลรวมของพลังงานศักย์ (คือพลังงานที่เกิดจากแรงดึงดูดระหว่างอิเล็กตรอนกับโปรตอน) และพลังงานจลน์ (คือพลังงานที่เกิดจากการเคลื่อนที่ของอิเล็กตรอน) ต่ำที่สุด คือสถานะพื้น(ground state) เมื่ออะตอมได้รับพลังงานความร้อนมากขึ้นอิเล็กตรอนจะรับพลังงานจำนวนหนึ่ง ทำให้อิเล็กตรอนมีพลังงานสูงขึ้น จึงต้องเปลี่ยนจากระดับพลังงานเดิมไปสู่ระดับพลังงานที่สูงขึ้น เรียกสภาวะใหม่นี้ว่าสถานะกระตุ้น (excited state) ที่สถานะกระตุ้นนี้อิเล็กตรอนไม่อยู่ตัว จึงมีการปรับตัวเข้าสู่ภาวะที่มีพลังงานต่ำ จะต้องคายพลังงานออกมาเท่ากับพลังงานที่รับเข้าไปในรูปของพลังงานแสงที่เป็นเส้นสเปกตรัม จึงสามารถเขียนอธิบายได้ดังรูปที่ 18
จากการทดลองเผาสารประกอบของโลหะให้เปลวไฟสีต่างๆ กันตามชนิดของโลหะ จึงทำให้เกิดความคิดที่ว่าโลหะน่าจะมีส่วนที่รับพลังงานความร้อนเข้าไป แล้วเปลี่ยนพลังงานความร้อนให้เป็นพลังงานแสง การที่โลหะต่างชนิดกัน ให้สีต่างกันนั้นอาจจะเป็นไปได้ว่าโลหะแต่ละชนิดคายพลังงานความร้อนออกมาได้ไม่เท่ากัน ความถี่และความยาวคลื่นแตกต่างกัน ตามกฎของพลังค์ ดังนั้นการอธิบายการเกิดสเปกตรัมจึงตั้งอยู่ในสมมุติฐานที่ว่า อะตอมน่าจะมีส่วนที่รับและคายพลังงาน จากแบบจำลองอะตอมของรัทเทอร์ฟอร์ด นักเรียนทราบมาแล้วว่า อิเล็กตรอนจะวิ่งรอบ ๆ นิวเคลียส ดังนั้นส่วนที่จะรับและคายพลังงานได้ ควรเป็นอิเล็กตรอน โดยอิเล็กตรอนจะเคลื่อนที่อยู่ในบริเวณที่มีผลรวมของพลังงานศักย์ (คือพลังงานที่เกิดจากแรงดึงดูดระหว่างอิเล็กตรอนกับโปรตอน) และพลังงานจลน์ (คือพลังงานที่เกิดจากการเคลื่อนที่ของอิเล็กตรอน) ต่ำที่สุด คือสถานะพื้น(ground state) เมื่ออะตอมได้รับพลังงานความร้อนมากขึ้นอิเล็กตรอนจะรับพลังงานจำนวนหนึ่ง ทำให้อิเล็กตรอนมีพลังงานสูงขึ้น จึงต้องเปลี่ยนจากระดับพลังงานเดิมไปสู่ระดับพลังงานที่สูงขึ้น เรียกสภาวะใหม่นี้ว่าสถานะกระตุ้น (excited state) ที่สถานะกระตุ้นนี้อิเล็กตรอนไม่อยู่ตัว จึงมีการปรับตัวเข้าสู่ภาวะที่มีพลังงานต่ำ จะต้องคายพลังงานออกมาเท่ากับพลังงานที่รับเข้าไปในรูปของพลังงานแสงที่เป็นเส้นสเปกตรัม จึงสามารถเขียนอธิบายได้ดังรูปที่ 18
รูปที่ 18 การดูดกลืนพลังงานของอิเล็กตรอน และเคลื่อนขึ้นไปอยู่ที่สภาวะกระตุ้น
ที่มา : Kotz , Treichel, and Weaver (2005 : 310)
6. การแปลความหมายเส้นสเปกตรัม
นักวิทยาศาสตร์ได้ใช้สเปกตรัมของธาตุไฮโดรเจนในการแปลความหมายของเส้นสเปกตรัม เพราะไฮโดรเจนมีอิเล็กตรอนเพียงตัวเดียว และมีเส้นสเปกตรัมไม่ซับซ้อน ทำให้ง่ายต่อการศึกษา ซึ่งสามารถอธิบายได้โดยอาศัยการทดลองของบาลเมอร์
บาร์เมอร์ได้ศึกษาการเกิดสเปกตรัมของก๊าซไฮโดรเจน พบว่าสเปกตรัมของไฮโดรเจนที่มองเห็น รูปที่ 19 การเปลี่ยนแปลงอิเล็กตรอนของไฮโดรเจนไปอยู่ในสภาวะกระตุ้น
นักวิทยาศาสตร์ได้ใช้สเปกตรัมของธาตุไฮโดรเจนในการแปลความหมายของเส้นสเปกตรัม เพราะไฮโดรเจนมีอิเล็กตรอนเพียงตัวเดียว และมีเส้นสเปกตรัมไม่ซับซ้อน ทำให้ง่ายต่อการศึกษา ซึ่งสามารถอธิบายได้โดยอาศัยการทดลองของบาลเมอร์
บาร์เมอร์ได้ศึกษาการเกิดสเปกตรัมของก๊าซไฮโดรเจน พบว่าสเปกตรัมของไฮโดรเจนที่มองเห็น รูปที่ 19 การเปลี่ยนแปลงอิเล็กตรอนของไฮโดรเจนไปอยู่ในสภาวะกระตุ้น
ด้วยตาเปล่ามี 4 เส้น คือ ม่วง น้ำเงิน น้ำทะเล และแดง ดังรูปที่ 19
ที่มา : Kotz , Treichel, and Weaver (2005 : 311)
เมื่อพิจารณาผลต่างระหว่าง พลังงานของเส้นสเปกตรัมของไฮโดรเจนทั้ง 4 เส้นได้ผลดังตารางที่ 3
จากข้อมูลจะเห็นว่า ความแตกต่างระหว่างพลังงานของแต่ละระดับอยู่ที่ถัดกันจะมีค่าไม่เท่ากัน และความแตกต่างจะมีค่าน้อยลง เมื่อระดับพลังงานสูงขึ้น จากการศึกษาเรื่องสเปกตรัมทำให้ได้ข้อสรุปว่า
1. เมื่ออิเล็กตรอนได้รับพลังงาน อิเล็กตรอนจะขึ้นไปอยู่ในระดับพลังงานที่สูงขึ้น แต่จะอยู่ในระดับพลังงานใด ก็ขึ้นอยู่กับปริมาณพลังงานที่ได้รับ การที่อิเล็กตรอนขึ้นไปสู่ระดับพลังงานใหม่ ซึ่งมีพลังงานสูงขึ้น ทำให้ อะตอมไม่เสถียร อิเล็กตรอนจึงเข้ามาอยู่ในระดับพลังงานที่ต่ำกว่าในการเปลี่ยนตำแหน่งอิเล็กตรอนจะคาย พลังงานออกมาในรูปคลื่นแม่เหล็กไฟฟ้า เมื่อส่องด้วยสเปกโทรสโคปจะปรากฏเป็นเส้นสเปกตรัม
2. อิเล็กตรอนอาจมีการเคลื่อนที่ในชั้นต่าง ๆ ได้ โดยไม่จำเป็นต้องเป็นชั้นที่อยู่ติดกัน จึงเป็นเหตุให้มีเส้น สเปกตรัมสีต่าง ๆ
3. ภายในอะตอมจะแบ่งพลังงานเป็นชั้นๆ โดยระดับพลังงานต่ำจะอยู่ใกล้นิวเคลียส ระดับพลังงานสูงอยู่ไกลนิวเคลียส ดังนั้นอิเล็กตรอนในระดับพลังงานต่ำจะอยู่ใกล้นิวเคลียส อิเล็กตรอนในระดับพลังงานสูงจะอยู่ไกลนิวเคลียส
4. ระดับพลังงานต่ำอยู่ห่างกัน ระดับพลังงานสูงจะอยู่ชิดกันมากขึ้น
4. ระดับพลังงานต่ำอยู่ห่างกัน ระดับพลังงานสูงจะอยู่ชิดกันมากขึ้น
จากความรู้เรื่องสเปกตรัม นีลย์ โบร์ จึงสร้างแบบจำลองอะตอมใหม่ ซึ่งมีลักษณะคล้ายกับแบบจำลองอะตอมของรัทเทอร์ฟอร์ด แต่แตกต่างกันเรื่องการจัดเรียงอิเล็กตรอน ดังนั้นอะตอมประกอบด้วยโปรตอนและนิวตรอนรวมกันเป็นนิวเคลียส โดยมีอิเล็กตรอนวิ่งรอบๆ นิวเคลียสเป็นชั้น ๆ ตามระดับพลังงาน
ฉะนั้นแบบจำลองอะตอมของโบร์ จึงคล้ายกับวงจรของดาวเคราะห์รอบดวงอาทิตย์ และเรียกระดับพลังงานที่ใกล้นิวเคลียสที่มีพลังงานต่ำที่สุดนี้ว่าชั้น K และชั้นถัด ๆ ไปเป็น L และ M ตามลำดับดังรูปที่ 20
รูปที่ 20 แบบจำลองอะตอมของโบร์
ที่มา : http://tinyurl.com/2ens6o4
7. แบบจำลองอะตอมกลุ่มหมอก
แบบจำลองอะตอมของโบร์ ใช้อธิบายเกี่ยวกับเส้นสเปกตรัมของธาตุไฮโดรเจนได้ดี แต่ไม่สามารถอธิบายเส้นสเปกตรัมของอะตอมที่มีหลายอิเล็กตรอนได้ จึงได้มีการศึกษาเพิ่มเติมทางกลศาสตร์ควอนตัม แล้วสร้างสมการสำหรับใช้คำนวณโอกาสที่จะพบอิเล็กตรอนในระดับพลังงานต่าง ๆ ขึ้นมา จนได้แบบจำลองใหม่ ที่เรียกว่าแบบจำลองอะตอมแบบกลุ่มหมอก ซึ่งมีรายละเอียดดังนี้ อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสอย่างรวดเร็ว ด้วยรัศมีไม่แน่นอนจึงไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้บอกได้แต่เพียงโอกาสที่จะพบอิเล็กตรอนในบริเวณต่าง ๆ ปรากฏการณ์แบบนี้เรียกว่ากลุ่มหมอกของอิเล็กตรอน บริเวณที่มีกลุ่มหมอกอิเล็กตรอนหนาแน่นจะมีโอกาสพบอิเล็กตรอนมากกว่าบริเวณที่เป็นหมอกจาง
การเคลื่อนที่ของอิเล็กตรอนรอบนิวเคลียสอาจเป็นรูปทรงกลมหรือรูปอื่น ๆ ขึ้นอยู่กับระดับพลังงานของอิเล็กตรอน แต่ผลรวมของกลุ่มหมอกของอิเล็กตรอนทุกระดับพลังงานจะเป็นรูปดังรูปที่ 21




































ความคิดเห็น
แสดงความคิดเห็น